Nitroksydy jako antyoksydanty – możliwości ich zastosowania w celach chemioprewencyjnych oraz radioprotekcyjnych
Sabina Tabaczar 1 , Marcin Talar 1 , Krzysztof Gwoździński 1Streszczenie
Nitroksydy jako trwałe rodniki organiczne początkowo wykorzystywane były jako znaczniki spinowe w spektroskopii elektronowego rezonansu paramagnetycznego (electron paramagnetic resonance – EPR) w badaniach takich parametrów jak pH środowiska wewnątrzkomórkowego, stopień nasycenia komórek lub tkanek tlenem, płynności błon biologicznych, stanu konformacyjnego białek, w topografii białek i enzymów. Nitroksydy są również wykorzystywane w biologii i medycynie, jako substancje kontrastowe w obrazowaniu metodą rezonansu magnetycznego (magnetic resonance imaging). Od odkrycia ich właściwości przeciwutleniających rozpoczęła się era badań nad potencjalnymi możliwościami ich wykorzystania jako syntetycznych antyutleniaczy. Nitroksydy biorą udział w reakcjach utleniania i redukcji zachodzących w komórce i mogą modulować stan redoks środowiska, w którym się znajdują. Dlatego też są intensywnie badane w różnych modelach stresu oksydacyjnego. Działanie antyutleniające nitroksydów wynika z ich zdolności do katalizowania reakcji dysmutacji anionorodnika ponadtlenkowego (rola pseudodysmutazowa), hamowania procesów utleniania (peroksydacji) lipidów, zapobiegania reakcji Fentona i Habera-Weissa przez utlenianie jonów metali przejściowych na niższym stopniu utlenienia oraz indukowania właściwości pseudokatalazowej białek hemowych. W pracy przedstawiono mechanizmy antyutleniających właściwości nitroksydów. Omówiono związek między budową, funkcją a szybkością redukcji nitroksydów w tkankach. Ponadto przedyskutowano możliwości zastosowania tych związków w celach chemioprewencyjnych oraz radioprotekcyjnych i podano przykłady.
Słowa kluczowe:nitroksyd • mimetyki SOD • stres oksydacyjny • Tempol
Summary
Nitroxides as stabile organic radicals were used initially as spin labels in spectroscopy of electron paramagnetic resonance (EPR) with respect to parameters such as pH of an intercellular environment, oxygenation of cells and tissues, fluidity of biological membranes, conformational state and topography of proteins. Nitroxides have also been used in biology and medicine as contrast agents in magnetic resonance imaging (MRI). When their antioxidant activities were discovered, an era of research on the potential utility of these agents began. Nitroxides can modulate the redox state of the cell by participation in oxidation/reduction reactions. Therefore, they are extensively examined in various models of oxidative stress. The antioxidant effect of nitroxides is a result of their ability to catalyze dismutation of superoxide radical (superoxide dismutase-like activity), inhibit lipid peroxidation, prevent Fenton and Haber-Weiss reactions by oxidation of transition metal ions to a higher oxidative state, and confer catalase-like activity on heme proteins. In the present paper the antioxidative mechanisms of nitroxides are presented. The relation between structure, function and the rate of nitroxide reduction inside cells and tissues is also presented. The application of nitroxides in chemoprevention and radioprotection is discussed.
Key words:nitroxide • SOD mimics • oxidative stress • Tempol
Wykaz skrótów:
EPR – elektronowy rezonans paramagnetyczny (electron paramagnetic resonance); kinaza ATM – kinaza białkowa serynowo-treoninowa (ataxia teleangiectasia mutated); MR – obrazowanie za pomocą rezonansu magnetycznego (magnetic resonance imaging); RFT – reaktywne formy tlenu (ROS – reactive oxygen species); Tempace – 4-acetamido 2,2,6,6-tetrametylopiperydyno-1-oksyl (Tempace, 4-acetamido-2,2,6,6-tetramethylpiperidine-N-oxyl); Tempamina – 4-amino-2,2,6,6-tetrametylopiperydyno-1-oksyl (Tempamine, 4-amino-2,2,6,6-tetramethylpiperidine-N-oxyl); Tempo – 2,2,6,6-tetrametylopiperydyno-1- oksyl (Tempo, 2,2,6,6-tetramethylpiperidine-1-oxyl); Tempol – 4-hydroksy-2,2,6,6-tetrametylopiperydyno-1-oksyl (Tempol, 4-hydroxy-2,2,6,6-tetramethylpiperidine-1-oxyl); Tempon – 2,2,6,6-tetrametylopiperydon-4-oksyl-1 (Tempone, 4-oxo-2,2,6,6-tetramethylpiperidine-1-oxyl).
1. Wprowadzenie
Nitroksydy są zróżnicowaną grupą stabilnych wolnych rodników organicznych (heterocyklicznych), charakteryzujących się obecnością grupy nitroksylowej >N•-O zawierającej niesparowany elektron. Ze względu na charakter paramagnetyczny związki te znalazły zastosowanie w spektroskopii EPR jako sondy i znaczniki spinowe w badaniach biochemiczno/biofizycznych, jako addukty w pułapkowaniu spinowym [18] oraz jako środki kontrastowe w obrazowaniu metodą rezonansu magnetycznego [37]. Kiedy wykazano, że nitroksydy działają antyutleniająco, tj. mają właściwości charakterystyczne dla dysmutazy ponadtlenkowej [65] oraz mogą hamować reakcje Fentona i Habera-Weissa [25] rozpoczęły się intensywne badania nad możliwościami ich wykorzystania. Wykazano m.in., że związki te mogą zapobiegać uszkodzeniom oksydacyjnym materiału genetycznego [80], hamować peroksydację lipidów [42,44], zapobiegać negatywnym skutkom towarzyszącym zespołowi po reperfuzji [83] lub niwelować działania niepożądane chemioterapii [16]. Dodatkowo wykazano, że nitroksydy podane w stężeniu 100 µmol/l nie działają toksycznie na komórki linii fibroblastów płucnych chomika chińskiego V79 [46], a sporadyczna cytotoksyczność tych związków wynikać może z zastosowania zbyt dużego ich stężenia [14,53]. Nitroksydy, ulegając w komórce procesom utleniania i redukcji na ogół nie zużywają się stechiometrycznie, a struktura elektronowa i molekularna nitroksydu nie ulega naruszeniu podczas reakcji substytucji [68].
2. Budowa chemiczna nitroksydów
Najczęściej stosowane nitroksydy są związkami heterocyklicznymi pięcio- lub sześcioczłonowymi i charakteryzują się obecnością grupy nitroksylowej z niesparowanym elektronem. Gęstość ładunku jest prawie równo rozłożona między atomem tlenu i azotu. Stabilność wolnego rodnika nitroksydu wynika ze sterycznie upakowanego układu, tj. obecności grup metylowych, znajdujących się przy atomach węgla w pozycjach α atomu azotu (ryc. 1). Brak atomów wodoru przy α atomach węgla nie dopuszcza do reakcji dysproporcjonowania między dwoma rodnikami oraz ogranicza dostęp innym substancjom, które mogłyby doprowadzić do wygaszenia spinu [76].

Ryc. 1. Stabilizacja rodnika nitroksydowego (Tempo), pochodnej 2,2,6,6-tetrametylopiperydyny przez grupy metylowe
Ze względu na strukturę chemiczną pierścienia, można wyróżnić najczęściej stosowane typy nitroksydów:
• zawierające pierścień pięcioczłonowy z atomami tlenu i azotu – nitroksydy oksazolidynowe,
• mające pierścień pięcioczłonowy (nasycony) z atomem azotu – nitroksydy pirolidynowe,
• zawierające pierścień pięcioczłonowy (nienasycony) z atomem azotu – nitroksydy pirolinowe,
• zbudowane z sześcioczłonowego pierścienia – nitroksydy piperydynowe (ryc. 2).

Ryc. 2. Budowa pierścieni heterocyklicznych nitroksydów oraz ich pochodnych: A – oksazolidynowy, B – nasycony pirolidynowy, C – nienasycony pirolinowy, D – piperydynowy. X może być atomem wodoru (aminy drugorzędowe), grupą -OH w przypadku hydroksyloamin, atomem tlenu – stabilny rodnik nitroksylowy oraz atomem tlenu z podwójnym wiązaniem ze zlokalizowanym ładunkiem dodatnim (=O+) – kation oksoamoniowy
Do grupy stabilnych rodników nitroksylowych zaliczyć można również wiele pochodnych, mających zamiast grup metylowych w pozycji 5 inne podstawniki. Do pochodnych tych należą m.in. nitroksydy oparte na pierścieniu pirolidynowym, tzw. nitroksydy proksylowe, mające podstawniki w pozycji 5,5 pierścienia oraz azetoksylowe z podstawnikami w pozycji 2,5. Te ostatnie mogą występować również w postaci konformacji cis i trans. Dodatkowo wyróżnić można pochodne paramagnetyczne oksazolidyny mające podstawniki w pozycji 5,5 zwane nitroksydami doksylowymi (ryc. 2).
3. Związek między budową nitroksydu a jego właściwościami antyoksydacyjnymi
Na właściwości antyoksydacyjne nitroksydów decydujący wpływ ma rodzaj pierścienia, obecność grup funkcyjnych, ładunek oraz stopień nasycenia wiązań chemicznych w pierścieniu [14,20,27]. W przypadku reakcji nitroksydów z rodnikiem wodoronadtlenkowym (HO2•) istotny wpływ na szybkość reakcji ma rodzaj pierścienia nitroksydu oraz obecność grup funkcyjnych [24]. Stwierdzono, że nitroksydy sześcioczłonowe charakteryzują się większą reaktywnością z HO2•, a tym samym większą aktywnością antyutleniającą niż pięcioczłonowe. Natomiast na szybkość reakcji nitroksydu z rodnikami NO2• lub CO3• nie ma wpływu ani rodzaj pierścienia nitroksydu ani obecność podstawników. Stała szybkości tej reakcji nie zależy również od pH środowiska. W pH fizjologicznym nitroksydy mogą być lepszymi zmiataczami wolnych rodników niż glutation, cysteina lub kwas moczowy [24].
Według niektórych autorów większa aktywność nitroksydów sześcioczłonowych wynikać może ze specyficznej budowy pierścienia. Nitroksydy, pochodne piperydyny mogą występować w postaci trzech konformacji: krzesełkowej, łódkowej lub skręconej (ryc. 4). Ogólnie jednak pochodne 2,2,6,6-tetrametylopiperydyny występują w formie krzesełkowej z kątem torsyjnym ok. 20 stopni (wykazano dla 2,2,6,6-tetrametylopiperydynolu-4-oksylu-1) [69]. Wykluczono natomiast strukturę łódkową, a jedynie 2,2,6,6-tetrametylopiperydon-4-oksyl-1 (Tempon) występuje w konformacji skręconej. Jednak wiązania CNOC tego rodnika wykazują strukturę płaską. Strukturę płaską wiązań CNOC wykazano również dla pochodnych 2,2,5,5-tetrametylopirolidyny (2,2,5,5-tetrametylopirolidynonu-3-oksylu-1) [69]. Jeśli przyjmiemy obecność jedynie formy krzesełkowej, to wydaje się, że jest ona uprzywilejowana w reakcjach redoks. Większa reaktywność nitroksydów piperydynowych może zatem wynikać z większego pofałdowania pierścienia, a więc lepszej dostępności grupy nitroksylowej dla odpowiednich reagentów w porównaniu z pierścieniem pirolidynowym lub bardziej płaskim pierścieniem pirolinowym, który wykazuje najmniejszą reaktywność [34]. Dodatkowo nitroksydy sześcioczłonowe szybciej ulegają redukcji do hydroksyloamin niż pięcioczłonowe, co może mieć decydujący wpływ na ich reaktywność z innymi wolnymi rodnikami [4,27,28,29,77].

Ryc. 4. Konformacje nitroksydów piperydynowych: A – krzesełkowa, B – łódkowa, C – skręcona
O reaktywności (np. redukcji) nitroksydów piperydynowych decyduje obecność odpowiednich podstawników. Podstawniki, zwłaszcza te w pozycji 4, mają istotny wpływ na właściwości antyoksydacyjne nitroksydów. Mogą one modulować lipofilność nitroksydów wpływając na szybkość ich redukcji oraz wprowadzać ładunek [14,27,28,29,30,45,62]. Na przykład Tempo i Tempol wykazują porównywalną szybkość redukcji, podobnie jak para Tempamina i Tempon, ale szybkość redukcji dwóch ostatnich jest prawie 3 razy szybsza (Gwoździński, wyniki niepublikowane). Podane przykłady dla pochodnych piperydyny pokazują, że reaktywność nitroksydów związana z utratą spinu nie zależy od struktury konformacyjnej a od gęstości elektronowej. Wzrost gęstości elektronowej, decyduje o większej reaktywności.
Jeśli porównamy szybkości redukcji nitroksydów piperydynowych z pochodnymi piroliny i pirolidyny, to redukują się one znacznie szybciej [27]. W tym przypadku decyduje struktura pierścienia, a także obecność podstawników. Wykazano, że wprowadzenie do pierścienia piperydynowego w pozycji 4 grupy acetamidowej (Tempace) skutkuje lepszymi właściwościami antyoksydacyjnymi in vitro powstałego związku w porównaniu do nitroksydów z grupą aminową (Tempamina) lub grupą hydroksylową (Tempol) [14]. Stwierdzono, że nitroksydy mające tendencję do utrzymywania ładunku dodatniego, takie jak np. Tempamina, lepiej chroniły DNA przed uszkodzeniami wywołanymi stresem oksydacyjnym spowodowanym naświetlaniem niż ujemnie naładowane nitroksydy, np. 3-karboksy 2,2,5,5-tetrametylopirolidyno-1-oksyl [34].
4. Udział nitroksydów w reakcjach redoks
Nitroksydy występują w tkankach w dwóch stanach redoks, to jest utlenionym i zredukowanym. Równowaga między postacią utlenioną a zredukowaną jest zależna od wewnątrzkomórkowego stanu redoks, w tym obecności innych substancji mogących brać udział w procesach utleniania i redukcji [52]. Rodnik nitroksylowy może ulec redukcji do hydroksyloaminy:

w obecności reduktorów, takich jak jony żelaza (II) lub kwas askorbinowy [56] lub zostać utleniony do kationu oksoamoniowego:

przez anionorodnik ponadtlenkowy lub rodnik hydroksylowy [23].
Kation oksoamoniowy może ulegać jednoelektronowej redukcji do postaci stabilnego rodnika lub ulegać dwuelektronowej redukcji z udziałem alkoholi, tioli i zredukowanych dinukleotydów nikotynoamidoadeninowych (NADH i NADPH) do hydroksyloaminy [12,38,39]. Hydroksyloamina jest stosunkowo trwała, lecz pod wpływem anionorodnika ponadtlenkowego może być utleniona do rodnika (ryc. 3). Możliwość przechodzenia rodników nitroksylowych w stan zredukowany lub utleniony decyduje o ich właściwościach antyoksydacyjnych. Utlenianie nitroksydu do kationu oksoamionowego ma znaczenie dla katalizowania reakcji dysmutacji anionorodnika ponadtlenkowego, podczas gdy hydroksyloamina funkcjonuje jako typowy związek redukujący na podobnej zasadzie jak witamina C lub E [23,46]. W przypadku silnych reduktorów nitroksydy ulegają dwuelektronowej redukcji do amin drugorzędowych.

Ryc. 3. Formy redoks nitroksydów: A – hydroksyloamina, B – nitroksyd, C – kation oksoamoniowy
5. Metabolizm nitroksydów
Redukcja nitroksydów do hydroksyloamin i amin drugorzędowych zachodzi wewnątrzkomórkowo w erytrocytach, keratynocytach, wątrobie oraz nerkach [4,27,28,29,30,51]. Głównym miejscem enzymatycznej redukcji są mitochondria i mikrosomy wątroby, gdzie nitroksydy metabolizowane są z udziałem reduktazy cytochromu P-450 [79]. W procesie redukcji nitroksydów w keratynocytach ważną rolę odgrywa reduktaza tioredoksyny [51]. Szybkość redukcji nitroksydu jest zależna od rodzaju pierścienia, ładunku nitroksydu, rozpuszczalności w tłuszczach oraz stężenia wewnątrzkomórkowych reduktorów. Najbardziej oporne na redukcję są nitroksydy mające ładunek ujemny lub dodatni, takie jak karboksynitroksydy oraz czwartorzędowe sole amoniowe [27,28,29,30] lub pochodne imidazolowe z podstawnikami tetraetylowymi [43].
Wewnątrz komórek nitroksydy mogą być również redukowane z udziałem kwasu askorbinowego [56] oraz glutationu [4,21,52,74] lub przez reduktazy komórkowe [38,39]. Redukcja nitroksydu przez witaminę C do hydroksyloaminy zachodzi w wyniku reakcji z anionem askorbinianowym. Jednoelektronowe utlenienie cząsteczki anionu askorbinianowego prowadzi do powstania rodnika askorbylowego:

Na skutek utraty kolejnego elektronu przez rodnik askorbylowy powstaje kwas dehydroaskorbinowy, z którym reagować może powstała wcześniej hydroksyloamina dając kolejny rodnik askorbylowy:

Kwas dehydroaskorbinowy może być redukowany do cząsteczki kwasu askorbinowego z udziałem glutationu lub reduktazy selenozależnej [35,59]. Pod wpływem glutationu następuje także regeneracja rodników askorbylowych do kwasu askorbinowego. Proces dysmutacji tych rodników może się odbywać z dużą wydajnością na skutek działania nitroksydów, które katalizują ten proces:

Kwas askorbinowy może również przeprowadzać redukcję kationu oksoamoniowego do hydroksyloaminy [4].
W procesie redukcji nitroksydów ważną rolę odgrywa glutation (GSH), który mimo że nie oddziałuje bezpośrednio z nitroksydami, to z powodu pełnionej funkcji utrzymywania odpowiedniego stanu redoks komórki przyczynia się do ich redukcji [21,52,78].
6. Mechanizm działania nitroksydów
Dysmutacja anionorodnika ponadtlenkowego
Nitroksydy są związkami o małej masie cząsteczkowej około 200, łatwo przenikającymi przez błony biologiczne mimetykami dysmutazy ponadtlenkowej (SOD). Nazwa mimetyki SOD pochodzi od ich zdolności do katalizowania procesu dysmutacji anionorodnika ponadtlenkowego O2•–, produktu jednoelektronowej redukcji tlenu cząsteczkowego [47]. Proces ten katalizowany jest w komórkach z udziałem dysmutaz ponadtlenkowych (cytosolowej lub zewnątrzkomórkowej CuZnSOD, wewnątrzmitochondrialnej MnSOD lub bakteryjnej FeSOD). Anionorodnik ponadtlenkowy powstaje w komórkach głównie na skutek „przecieku” elektronów w mitochondrialnym łańcuchu oddechowym oraz w katalizowanej przez oksydazę ksantynową reakcji utleniania hipoksantyny i ksantyny do kwasu moczowego z udziałem reduktazy NADPH i reduktazy cytochromu P-450 podczas metabolizmu ksenobiotyków w mikrosomach. Źródłem O2•- są również neutrofile i makrofagi.
Katalizowanie procesu dysmutacji anionorodnika przez nitroksydy jest możliwe dzięki cyklicznym reakcjom redoks. Stwierdzono, że wydajność reakcji dysmutacji katalizowanej przez nitroksydy zależy od szybkości z jaką nitroksyd ulega utlenieniu do kationu oksoamoniowego na skutek działania anionorodnika ponadtlenkowego (6) [48]:

Kation ten może ulec redukcji pod wpływem kolejnej cząsteczki anionorodnika do związku wyjściowego (7):

Jednocześnie z reakcjami (6) i (7) zachodzi reakcja samorzutnej dysmutacji, w której z dwóch cząsteczek anionorodnika ponadtlenkowego z udziałem dwóch protonów powstaje nadtlenek wodoru i tlen cząsteczkowy, jednak proces ten jest wolniejszy w porównaniu z działaniem dysmutazy (8):

Stała szybkości procesu katalizowanego przez nitroksydy wynosi od 1*106 do 108 M-1 s-1 [24,83], natomiast w przypadku CuZnSOD szybkość zmiatania O2•- sięga rzędu 2*109 M-1 s-1 [5]. Najbardziej wydajna reakcja dysmutacji zachodzi z udziałem nitroksydów piperydynowych, które zdolne są do katalizowania reakcji dysmutacji anionorodnika ponadtlenkowego w zakresie pH 4,0-5,0, ze stałą szybkości tylko o jeden rząd niższą niż w przypadku reakcji katalizowanej przez dysmutazę CuZn SOD [24]. Nitroksydy, ze względu na niską masę cząsteczkową, mają zdolność przenikania przez błony biologiczne, mogą zatem skutecznie katalizować dysmutację anionorodnika w miejscach niedostępnych dla SOD [73].
Hamowanie reakcji Fentona i Habera-Weissa
Stwierdzono, że nitroksydy mogą hamować reakcję Fentona (9) i katalizowaną jonami metali przejściowych reakcję Habera-Weissa (11) [76]. W reakcji Fentona w obecności jonów metali przejściowych, tj. Fe2+, Cu+ następuje redukcja nadtlenku wodoru na rodnik wodorotlenkowy i anion wodorotlenkowy:

Utleniony jon metalu ulega redukcji, a anionorodnik ponadtlenkowy utlenieniu do tlenu cząsteczkowego:

Powstały jon żelaza (II) może ponownie wchodzić w reakcję z nadtlenkiem wodoru inicjując powstawanie coraz większych ilości rodnika wodorotlenkowego (reakcja 9).
Reakcja Fentona i reakcja redukcji jonów Fe3+ przez anionorodnik ponadtlenkowy stanowią składowe reakcji Habera-Weissa, której sumaryczny zapis jest następujący:

Hamowanie wytwarzania wolnych rodników poprzez nitroksydy opiera się na ich reakcji z utlenionymi metalami według reakcji [65]:

Hamowanie procesu peroksydacji lipidów
Obecność niesparowanego elektronu przy grupie nitroksylowej sprzyja reakcjom rekombinacji z innymi rodnikami, takimi jak rodniki nadtlenkowe, alkoksylowe i in., co sprawia, że nitroksydy mogą hamować proces peroksydacji lipidów. Hamowanie to może odbywać się na różnych etapach kaskady reakcji wolnorodnikowych. Inhibicję procesu peroksydacji lipidów przez nitroksydy zaobserwowano in vitro oraz in vivo [10,14,44,67].
Proces peroksydacji rozpoczyna się od zainicjowania rozpadu homolitycznego wiązania węgiel-wodór w łańcuchu polimetylenowym nienasyconego kwasu tłuszczowego lipidu (13). Czynnikiem inicjującym (X•) może być m.in. rodnik wodorotlenkowy, jony żelaza na wyższych stopniach utlenienia (postać ferrylowa lub nadferrylowa), nadtlenoazotyn lub ditlenek azotu:

Nitroksydy i ich formy zredukowane w postaci hydroksyloamin mogą reagować z czynnikami inicjującymi proces peroksydacji przeciwdziałając reakcji łańcuchowej i zapobiegając tym samym uszkodzeniom lipidów:

Jeśli w procesie inicjacji nie zostanie zahamowany ten etap reakcji, a jednocześnie w środowisku występuje dostatecznie dużo tlenu cząsteczkowego następuje kolejny etap peroksydacji, propagacja. Liczba rodników nie ulega wtedy zmianie, dochodzi natomiast do zmiany postaci nośników niesparowanych elektronów (reakcje 16-19). W reakcjach propagacji następuje naprzemienne przyłączenie tlenu do rodnika lipidowego lub odrywanie atomu wodoru od nowego łańcucha nienasyconego kwasu tłuszczowego przez rodniki nadtlenkowe lub alkoksylowe lipidów:
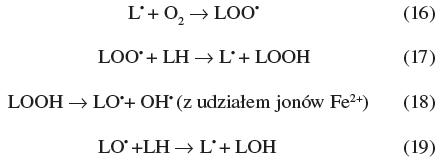
Jeśli w środowisku reakcyjnym nie ma wolnych jonów metali na niższym stopniu utlenienia wówczas reakcja może być zatrzymana na etapie wodoronadtlenków. Natomiast w obecności jonów metali przejściowych proces rozpadu lipidu postępuje nadal prowadząc do fragmentacji łańcuchów węglowodorowych kwasów tłuszczowych wchodzących w skład lipidów, a produktami końcowymi są m.in. dialdehyd malonowy, 4-hydroksynonenal, etan i pentan.
W chwili pojawienia się deficytu tlenu lub przy braku substratów do kolejnych reakcji proces peroksydacji kończy się na etapie terminacji, w którym dochodzi często do sieciowania lipidów (reakcje 20-22) [8]:

Nitroksydy zapobiegają etapowi propagacji, reakcji wolnorodnikowej (reakcja rekombinacji) poprzez oddziaływanie z utlenionymi lipidami [76]:

Indukcja właściwości pseudokatalazowych białek hemowych
Stwierdzono, że nitroksydy mają zdolność detoksyfikacji reaktywnych postaci białek hemowych, takich jak pochodne ferrylowe i nadferrylowe [61]. Dodatkowo zaobserwowano, że nitroksydy mogą indukować właściwości pseudokatalazowe białek hemowych [50]. Utlenowana postać hemoglobiny i mioglobiny, odpowiednio oksyhemoglobina i oksymioglobina (oksyHbFeII i oksyMbFeII) mogą ulegać autoutlenieniu, w wyniku którego powstaje methemoglobina i metmioglobina zawierająca żelazo na trzecim stopniu utlenienia (HbFeIII, MbFeIII) oraz anionorodnik ponadtlenkowy:

który ulega dysproporcjowaniu do nadtlenku wodoru H2O2 oraz tlenu cząsteczkowego O2 (reakcja 8). W wyniku reakcji methemoglobiny i metmioglobiny z powstałym nadtlenkiem wodoru powstaje nietrwały rodnik globinowy (postać ferrylowa) oraz wodoronadtlenkowy:

Dodatkowo może również powstawać wysoce reaktywna i trwalsza od rodnika globinowego postać ferrylowa hemoglobiny/mioglobiny (Hb(Mb)FeIV = O) [19]. Zarówno rodnik globinowy jak i ferrylowy prowadzić mogą do utleniania ważnych cząsteczek i makrocząsteczek [41,55].
Hb(Mb)FeIV może ulegać redukcji do Hb(Mb)FeIII, jednocześnie powodując utlenienie H2O2:

i tym samym wykazuje niewielkie właściwości pseudoperoksydazowe.
W procesie przemiany postaci ferrylowej metmioglobiny/hemoglobiny z udziałem nitroksydów następuje ich utlenienie do kationu oksoamoniowego, który w reakcji z nadtlenkiem wodoru ulega z powrotem redukcji do nitroksydu z uwolnieniem anionorodnika ponadtlenkowego (reakcja 30). Anionorodnik ponadtlenkowy jest utleniany do tlenu cząsteczkowego (31).

Przez nadawanie aktywności pseudokatalazowej hemoglobinie i metmioglobinie MbFeIII, która przeprowadzić może kolejny proces rozkładu nadtlenku wodoru nitroksydy przyczyniają się do detoksyfikacji środowiska komórkowego obniżając stężenie nadtlenku wodoru. Jednocześnie redukując postać ferrylową chronią struktury komórkowe przed uszkodzeniem [50].
7. Zastosowania nitroksydów
Chemioprewencja
Nadmierne wytwarzanie reaktywnych form tlenu (RFT) sprawia, że naturalne mechanizmy antyoksydacyjne komórki nie mogą utrzymać równowagi oksydacyjno-redukcyjnej, co prowadzi do zaburzeń homeostazy organizmu i skutkuje stresem oksydacyjnym. Stwierdzono, że stres oksydacyjny leży u podstaw etiopatologii wielu chorób cywilizacyjnych, w tym nowotworów [36]. Proces indukcji nowotworów przez RFT wiąże się z regulacją ekspresji genów [1] zwiększeniem szybkości proliferacji komórek [40] i wzrostem niestabilności genetycznej [82]. Stwierdzono, że zastosowanie antyoksydantów może zmniejszać ryzyko wystąpienia nowotworu [82]. Nitroksydy, ze względu na udział w procesach utleniania i redukcji mogą zmieniać stan redoks komórki, a tym samym hamować proces kancerogenezy. Działanie antynowotworowe nitroksydów wynikać może również z ingerencji tych związków w szlaki sygnałowe komórki.
Wstępne prace badawcze z zastosowaniem nitroksydów w celach chemioprewencyjnych są obiecujące. W badaniach przeprowadzonych na myszach C3H, którym podawano Tempol w wodzie lub pokarmie, wykazano, że nitroksyd ten poprzez redukcję masy ciała wpływał na zmniejszenie ryzyka wystąpienia nowotworu [66]. Działanie chemioprewencyjne nitroksydów zaobserwowano również w badaniach z wykorzystaniem modelu mysiego zespołu ataksji-teleangiektazji, choroby genetycznej wiążącej się z predyspozycją do zmian nowotworowych, wywołanych mutacją w genie kodującym białko atm. Białko to bierze udział w regulacji cyklu komórkowego, a jego nieprawidłowe funkcjonowanie prowadzić może m.in. do stresu oksydacyjnego [3]. Wykazano, że zastosowanie Tempolu oraz 5-karboksy-1,1,3,3 tetrametyloizoindolinylo-2-oksylu obniżało stres oksydacyjny oraz w znaczący sposób wydłużało życie myszy z mutacją w genie ATM [26,75].
Wykazano, że Tempol może być również stosowany w celach chemioprewencyjnych w niedokrwistości Fanconiego, choroby z predyspozycją do rozwoju nowotworu. Pacjenci z tą wrodzoną chorobą są szczególnie wrażliwi na RFT, które uszkadzając DNA prowadzą do mutacji i nowotworzenia. W badaniach przeprowadzonych na zmutowanych myszach Fancd2-/-Trp53+/- (model niedokrwistości Fanconiego z predyspozycją do rozwoju nowotworów nabłonkowych, heterozygoty pod względem białka p53) wykazano, że zastosowanie Tempolu w pożywieniu spowalniało proces nowotworzenia i wydłużało okres życia bez nowotworu. O prewencyjnym wpływie nitroksydu decydowały prawdopodobnie jego właściwości antyoksydacyjne, jako że nie stwierdzono bezpośredniego wpływu tego związku na szlaki sygnałowe (przekaźnictwa) w komórkach [85].
Inne badania z użyciem Tempolu wskazują jednak na udział tego nitroksydu w kaskadzie reakcji sygnałowych w komórce poprzez fosforylację białka p53 w pozycji seryny 18 [17]. Białko p53 reguluje progresję cyklu komórkowego i proces apoptozy, a jego zwiększona ilość, pojawiająca się w odpowiedzi na stres komórkowy, aktywuje białka uczestniczące w ujemnej regulacji cyklu komórkowego, np. białko p21WAF1/CIP1 oraz proapoptotyczne białko bax. Aby białko p53 mogło aktywować ekspresję czynników apoptotycznych niezbędna jest jego fosforylacja przebiegająca z udziałem kinazy białkowej serynowo-treoninowej (ataxia teleangiectasia mutated – ATM). Wykazano również, że Tempol znacząco wydłużał życie myszy z zespołem Li-Fraumeni, uwarunkowanej genetycznie choroby z predyspozycją do nowotworów, spowodowanej mutacją w genie kodującym białko p53. Prewencyjne działanie nitroksydu związane było z aktywacją szlaku proapoptotycznego na skutek fosforylacji białka p53, niezależnie od ATM [17].
Radioprotekcja
Promieniowanie jonizujące indukuje powstawanie wolnych rodników w komórkach na skutek radiolizy wody [70], dlatego też pacjenci poddawani radioterapii narażeni są na działania niepożądane spowodowane stresem oksydacyjnym [2,81]. W celach ochrony zdrowych tkanek stosuje się związki cytoprotekcyjne. Jednym z nich jest amifostyna, która ulegając utlenieniu zmiata wolne rodniki chroniąc błony śluzowe, skórę oraz ślinianki [10,57].
Podobne właściwości radioprotekcyjne in vitro [16,64] oraz in vivo [33,54] wykazują nitroksydy. Dodatkowo wykazano, że działanie radioprotekcyjne jest wybiórcze, chronione są tylko tkanki zdrowe [36,49]. Może to wynikać z szybszej bioredukcji nitroksydu w warunkach hipoksji tkanki guza [11], jako że właściwości ochronne mają tylko nitroksydy, podczas gdy produkty ich metabolizmu – hydroksyloaminy nie wykazują radioprotekcji [64]. Wykazano jednak, że w warunkach umożliwiających utlenienie hydroksyloaminy, z powrotem do rodnika działanie radioprotekcyjne jest możliwe [31,58].
Nie wszystkie nitroksydy wykazują jednakową radioprotekcję. Najbardziej efektywne są związki bez ładunku (Tempamina i 3-karbamoilo-2,2,5,5-tetrametylopirolidyno-1-oksyl) [34]. Dodatkowo, aby dany nitroksyd mógł chronić zdrowe tkanki przed skutkami naświetlania niezbędne jest jego przenikanie przez błony biologiczne. Wykazano, że obdarzony ładunkiem dodatnim kation nitroksydowy (1-oksyl-2,2,6,6-tetrametylopiperydylo-4-trimetylamoniowy) nie przenikał przez błony biologiczne i nie chronił komórek przed uszkodzeniami spowodowanymi promieniowaniem, podczas gdy Tempol wykazywał właściwości radioprotekcyjne [72]. Związek ten chronił lipidy poddawane naświetlaniu [71].
Jednym z działań niepożądanych radioterapii, mającym wpływ na jakość życia pacjenta jest utrata włosów [60]. W badaniach przeprowadzonych na świnkach morskich stwierdzono, że Tempol nałożony w postaci kompresu na skórę na 15 min przed naświetlaniem dawką 30 Gy chronił przed łysieniem i przyspieszał odrastanie włosów [22]. Podobne rezultaty uzyskał Cuscela i wsp. [13] badając ochronny wpływ Tempolu oraz Tempo na proces łysienia wywołany naświetlaniem.
Obiecujące wyniki badań na zwierzętach spowodowały, że Tempol został wprowadzony do badań klinicznych jako radioprotektor. W I fazie badań nitroksyd aplikowany był w roztworze 70% etanolu, w postaci kompresu na skórę głowy pacjentów poddawanych radioterapii. Nitroksyd był dobrze tolerowany przez organizm i wykazał właściwości protekcyjne wobec mieszków włosowych [63].
Podsumowanie
Na podstawie doniesień literaturowych, przedstawionych w niniejszym artykule, nitroksydy są obiecującymi związkami o szerokim zakresie aktywności antyutleniającej. Od odkrycia ich właściwości antyoksydacyjnych intensywnie badany jest ich udział w procesach redoks i wpływ na obniżanie stresu oksydacyjnego wywołanego przez różne czynniki. Wprowadzenie Tempolu do fazy badań klinicznych wydaje się krokiem prowadzącym do odkrycia nowych, potencjalnych zastosowań nitroksydów. Jednak w pewnych warunkach nitroksydy mogą również wykazywać działanie prooksydacyjne. Prooksydacyjny wpływ nitroksydów wykazano m.in. na erytrocytach. Inkubacja tych komórek z wzrastającymi stężeniami nitroksydów piperydynowych, pirolinowych i pirolidynowych prowadziła do spadku stężenia glutationu oraz aktywności enzymów zależnych od glutationu, takich jak peroksydaza glutationowa oraz transferaza glutationowa [6,7]. Wydaje się jednak, że również prooksydacyjne właściwości nitroksydów mogą znaleźć zastosowanie m.in. w terapii nowotworów. Rozwój badań nad możliwością wprowadzenia nitroksydów do terapii nowotworów będzie przedmiotem kolejnego opracowania.
PIŚMIENNICTWO
[1] Allen R.G., Tresini M.: Oxidative stress and gene regulation. Free Radic. Biol. Med., 2000; 28: 463-499
[PubMed]
[2] Barcellos-Hoff M.H.: How do tissues respond to damage at the cellular level? The role of cytokines in irradiated tissues. Radiat. Res., 1998; 150 (Suppl. 5): S109-S120
[PubMed]
[3] Barzilai A., Rotman G., Shiloh Y.: ATM deficiency and oxidative stress: a new dimension of defective response to DNA damage. DNA Repair, 2002; 1: 3-25
[PubMed]
[4] Bobko A.A., Kirilyuk I.A., Grigor’ev I.A., Zweier J.L., Khramtsov V.V.: Reversible reduction of nitroxides to hydroxylamines: roles for ascorbate and glutathione. Free Radic. Biol. Med., 2007; 42: 404-412
[PubMed] [Full Text HTML] [Full Text PDF]
[5] Buettner G.R., Ng C.F., Wang M., Rodgers V.G., Schafer F.Q.: A new paradigm: manganese superoxide dismutase influences the production of H2O2 in cells and thereby their biological state. Free Radic. Biol. Med., 2006; 41: 1338-1350
[PubMed] [Full Text HTML] [Full Text PDF]
[6] Bujak S., Gwoździński K.: Nitroxides lead to reduced level of glutathione in red blood cells. In: Free Radical and oxidative stress: Chemistry and Pathological implications, ed.: G. Galaris, Medimond International Proceedings, 2003, 105-108
[7] Bujak S., Gwoździński K.: The effect of stable nitroxide radicals on the activity of glutathione-dependent enzymes: reductase, peroxidase and transferase in human erythrocyte. Society for Free Radical Research International, Proceedings of the XIII Congress, Medimont S.r.l, 2006, 71-74
[8] Catalá A.: Lipid peroxidation of membrane phospholipids generates hydroxy-alkenals and oxidized phospholipids active in physiological and/or pathological conditions. Chem. Phys. Lipids, 2009; 157: 1-11
[PubMed]
[9] Cimato A.N., Piehl L.L., Facorro G.B., Torti H.B., Hager A.A.: Antioxidant effects of water- and lipid-soluble nitroxide radicals in liposomes. Free Radic. Biol. Med., 2004; 37: 2042-2051
[PubMed]
[10] Citrin D., Cotrim A.P., Hyodo F., Baum B.J., Krishna M.C., Mitchell J.B.: Radioprotectors and mitigators of radiation-induced normal tissue injury. Oncologist, 2010; 15: 360-371
[PubMed] [Full Text HTML] [Full Text PDF]
[11] Cotrim A.P., Hyodo F., Matsumoto K., Sowers A.L., Cook J.A., Baum B.J., Krishna M.C., Mitchell J.B.: Differential radiation protection of salivary glands versus tumor by Tempol with accompanying tissue assessment of Tempol by magnetic resonance imaging. Clin. Cancer Res., 2007; 13: 4928-4933
[PubMed] [Full Text HTML] [Full Text PDF]
[12] Couet W.R., Brasch R.C., Sosnovsky G., Tozer T.N.: Factors affecting nitroxide reduction in ascorbate solution and tissue homogenates. Magn. Reson. Imaging, 1985; 3: 83-88
[PubMed]
[13] Cuscela D., Coffin D., Lupton G.P., Cook J.A., Krishna M.C., Bonner R.F., Mitchell J.B.: Protection from radiation-induced alopecia with topical application of nitroxides: fractionated studies. Cancer J. Sci. Am., 1996; 2: 273-278
[PubMed]
[14] Czepas J., Koceva-Chyła A., Gwoździński K., Jóźwiak Z.: Different effectiveness of piperidine nitroxides against oxidative stress induced by doxorubicin and hydrogen peroxide. Cell Biol. Toxicol., 2008; 24: 101-112
[PubMed]
[15] DeGraff W.G., Krishna M.C., Kaufman D., Mitchell J.B.: Nitroxide-mediated protection against X-ray- and neocarzinostatin-induced DNA damage. Free Radic. Biol. Med., 1992; 13: 479-487
[PubMed]
[16] Deres P., Halmosi R., Toth A., Kovacs K., Palfi A., Habon T., Czopf L., Kalai T., Hideg K., Sumegi B., Toth K.: Prevention of doxorubicin-induced acute cardiotoxicity by an experimental antioxidant compound. J. Cardiovasc. Pharmacol., 2005; 45: 36-43
[PubMed]
[17] Erker L., Schubert R., Yakushiji H., Barlow C., Larson D., Mitchell J.B., Wynshaw-Boris A.: Cancer chemoprevention by the antioxidant tempol acts partially via the p53 tumor suppressor. Hum. Mol. Genet., 2005; 14: 1699-1708
[PubMed] [Full Text HTML] [Full Text PDF]
[18] Gallez B., Mäder K., Swartz H.M.: Noninvasive measurement of the pH inside the gut by using pH-sensitive nitroxides. An in vivo EPR study. Magn. Reson. Med., 1996; 36: 694-697
[PubMed]
[19] Giulivi C., Cadenas E.: Ferrylmyoglobin: formation and chemical reactivity toward electron-donating compounds. Methods Enzymol., 1994; 233: 189-202
[PubMed]
[20] Głębska J., Gwoździński K.: Nitroxides as protectors against oxidative damage induced by the Fenton system. Curr. Top. Biophys., 2000; 24: 57-63
[21] Głębska J., Skolimowski J., Kudzin Z., Gwoździński K., Grzelak A., Bartosz G.: Pro-oxidative activity of nitroxides in their reactions with glutathione. Free Radic. Biol. Med., 2003; 35: 310-316
[PubMed]
[22] Goffman T., Cuscela D., Glass J., Hahn S., Krishna C.M., Lupton G., Mitchell J.B.: Topical application of nitroxide protects radiation-induced alopecia in guinea pigs. Int. J. Radiat. Oncol. Biol. Phys., 1992; 22: 803-806
[PubMed]
[23] Goldstein S., Merenyi G., Russo A., Samuni A.: The role of oxoammonium cation in the SOD-mimic activity of cyclic nitroxides. J. Am. Chem. Soc., 2003; 125: 789-795
[PubMed]
[24] Goldstein S., Samuni A., Hideg K., Merenyi G.: Structure-activity relationship of cyclic nitroxides as SOD mimics and scavengers of nitrogen dioxide and carbonate radicals. J. Phys. Chem. A, 2006; 110: 3679-3685
[PubMed]
[25] Grinberg L.N., Samuni A.: Nitroxide stable radical prevents primaquine-induced lysis of red blood cell. Biochim. Biophys. Acta, 1994; 1201: 284-288
[PubMed]
[26] Gueven N., Luff J., Peng C., Hosokawa K., Bottle S.E., Lavin M.F.: Dramatic extension of tumor latency and correction of neurobehavioral phenotype in Atm-mutant mice with a nitroxide antioxidant. Free Radic. Biol. Med., 2006; 41: 992-1000
[PubMed]
[27] Gwoździński K., Bartosz G.: Nitroxides reduction in human red blood cells. Curr. Top. Biophys., 1996; 20 (Suppl.): 60-65
[28] Gwoździński K., Bartosz G., Leyko W.: Effect of gamma radiation on the transport of spin-labeled compounds across the erythrocyte membrane. Radiat. Environ. Biophys., 1981; 19: 275-285
[PubMed]
[29] Gwoździński K., Bartosz G., Leyko W.: Effect of gamma radiation on the transport of non-electrolyte spin labels across human erythrocyte. Stud. Biophys., 1981; 86: 187-192
[30] Gwoździński K., Bartosz G., Leyko W.: Effect of gamma radiation on the transport of electrolyte spin labels across human erytrocyte. Stud. Biophys. 1982; 89: 141-145
[31] Hahn S.M., Krishna M.C., DeLuca A.M., Coffin D., Mitchell J.B.: Evaluation of the hydroxylamine Tempol-H as an in vivo radioprotector. Free Radic. Biol. Med., 2000; 28: 953-958
[PubMed]
[32] Hahn S.M., Sullivan F.J., DeLuca A.M., Krishna C.M., Wersto N., Venzon D., Russo A., Mitchell J.B.: Evaluation of tempol radioprotection in a murine tumor model. Free Radic. Biol. Med., 1997; 22: 1211-1216
[PubMed]
[33] Hahn S.M., Tochner Z., Krishna C.M., Glass J., Wilson L., Samuni A., Sprague M., Venzon D., Glatstein E., Mitchell J.B., Russo A.: Tempol, a stable free radical, is a novel murine radiation protector. Cancer Res., 1992; 52: 1750-1753
[PubMed] [Full Text PDF]
[34] Hahn S.M., Wilson L., Krishna C.M., Liebmann J., DeGraff W., Gamson J., Samuni A., Venzon D., Mitchell J.B.: Identification of nitroxide radioprotectors. Radiat. Res., 1992; 132: 87-93
[PubMed]
[35] Halliwell B.: Vitamin C: poison, prophylactic or panacea? Trends Biochem. Sci., 1999; 24: 255-259
[PubMed]
[36] Halliwell B.: Oxidative stress and cancer: have we moved forward? Biochem. J., 2007; 401: 1-11
[PubMed] [Full Text HTML] [Full Text PDF]
[37] Hyodo F., Chuang K.H., Goloshevsky A.G., Sulima A., Griffiths G.L., Mitchell J.B., Koretsky A.P., Krishna M.C.: Brain redox imaging using blood-brain barrier-permeable nitroxide MRI contrast agent. J. Cereb. Blood Flow Metab., 2008; 28: 1165-1174
[PubMed] [Full Text HTML] [Full Text PDF]
[38] Iannone A., Bini A., Swartz H.M., Tomasi A., Vannini V.: Metabolism in rat liver microsomes of the nitroxide spin probe tempol. Biochem. Pharmacol., 1989; 38: 2581-2586
[PubMed]
[39] Iannone A., Hu H.P., Tomasi A., Vannini V., Swartz H.M.: Metabolism of aqueous soluble nitroxides in hepatocytes: effects of cell integrity, oxygen, and structure of nitroxides. Biochim. Biophys. Acta, 1989; 991: 90-96
[PubMed]
[40] Irani K., Xia Y., Zweier J.L., Sollott S.J., Der C.J., Fearon E.R., Sundaresan M., Finkel T., Goldschmidt-Clermont P.J.: Mitogenic signaling mediated by oxidants in Ras-transformed fibroblasts. Science, 1997; 275: 1649-1652
[PubMed]
[41] Irwin J.A., Ostdal H., Davies M.J.: Myoglobin-induced oxidative damage: evidence for radical transfer from oxidized myoglobin to other proteins and antioxidants. Arch. Biochem. Biophys., 1999; 362: 94-104
[PubMed]
[42] Kato N., Yanaka K., Hyodo K., Homma K., Nagase S., Nose T.: Stable nitroxide Tempol ameliorates brain injury by inhibiting lipid peroxidation in a rat model of transient focal cerebral ischemia. Brain Res., 2003; 979: 188-193
[PubMed]
[43] Kirilyuk I.A., Bobko A.A., Grigor’ev I.A., Khramtsov V.V.: Synthesis of the tetraethyl substituted pH-sensitive nitroxides of imidazole series with enhanced stability towards reduction. Org. Biomol. Chem., 2004; 2: 1025-1030
[PubMed]
[44] Koceva-Chyła A., Gwoździński K., Kochman A., Stolarska A., Jóźwiak Z.: Effects of pyrroline and pyrrolidine nitroxides on lipid peroxidation in heart tissue of rats treated with doxorubicin. Cell. Mol. Biol. Lett. 2003; 8: 179-183
[PubMed]
[45] Koceva-Chyła A., Kochman A., Głębska J., Gwoździński K., Jóźwiak Z., Metodiewa D.: Tempicol-3, a novel piperidine-N-oxide stable radical and antioxidant, with low toxicity acts as apoptosis inducer and cell proliferation modifier of Yoshida Sarcoma cells in vivo. Anticancer Res., 2000; 20: 4611-4618
[PubMed]
[46] Krishna M.C., DeGraff W., Hankovszky O.H., Sár C. P., Kálai T., Jeko J., Russo A., Mitchell J.B., Hideg K.: Studies of structure-activity relationship of nitroxide free radicals and their precursors as modifiers against oxidative damage. J. Med. Chem., 1998; 41: 3477-3492
[PubMed]
[47] Krishna M.C., Grahame D.A., Samuni A., Mitchell J.B., Russo A.: Oxoammonium cation intermediate in the nitroxide-catalyzed dismutation of superoxide. Proc. Natl. Acad. Sci. USA, 1992; 89: 5537-5541
[PubMed] [Full Text PDF]
[48] Krishna M.C., Russo A., Mitchell J.B., Goldstein S., Dafni H., Samuni A.: Do nitroxide antioxidants act as scavengers of O2 – or as SOD mimics? J. Biol. Chem., 1996; 271: 26026-26031
[PubMed] [Full Text HTML] [Full Text PDF]
[49] Krishna M.C., Samuni A.: The effect of oxygen at physiological levels on the detection of free radical intermediates by electron paramagnetic resonance. Free Radic. Res. Commun., 1993; 18: 239-247
[PubMed]
[50] Krishna M.C., Samuni A., Taira J., Goldstein S., Mitchell J.B., Russo A.: Stimulation by nitroxides of catalase-like activity of hemeproteins. Kinetics and mechanism. J. Biol. Chem. 1996; 271: 26018-26025
[PubMed] [Full Text HTML] [Full Text PDF]
[51] Kroll C., Langner A., Borchert H.H.: Nitroxide metabolism in the human keratinocyte cell line HaCaT. Free Radic. Biol. Med., 1999; 26: 850-857
[PubMed]
[52] Kuppusamy P., Li H., Ilangovan G., Cardounel A.J., Zweier J.L., Yamada K., Krishna M.C., Mitchell J.B.: Noninvasive imaging of tumor redox status and its modification by tissue glutathione levels. Cancer Res., 2002; 62: 307-312
[PubMed] [Full Text HTML] [Full Text PDF]
[53] Lewińska A., Wnuk M., Slota E., Bartosz G.: The nitroxide antioxidant Tempol affects metal-induced cyto- and genotoxicity in human lymphocytes in vitro. Mutat. Res., 2008; 649: 7-14
[PubMed]
[54] Liebmann J., DeLuca A.M., Epstein A., Steinberg S.M., Morstyn G., Mitchell J.B.: Protection from lethal irradiation by the combination of stem cell factor and tempol. Radiat. Res., 1994; 137: 400-404
[PubMed]
[55] Martínez R., Quintana K., Navarro R., Martín C., Hernández M.L., Aurrekoetxea I., Ruiz-Sanz J.I., Lacort M., Ruiz-Larrea M.B.: Pro-oxidant and antioxidant potential of catecholestrogens against ferrylmyoglobin-induced oxidative stress. Biochim. Biophys. Acta, 2002; 1583: 167-175
[PubMed]
[56] Marx L., Chiarelli R., Guiberteau T., Rassat A.: A comparative study of the reduction by ascorbate of 1,1,3,3-tetraethylisoindolin-2-yloxyl and of 1,1,3,3-tetramethylisoindolin-2-yloxyl. J. Chem. Soc. Perkin Trans. 1, 2000; 8: 1181-1182
[57] Marzatico F., Porta C., Moroni M., Bertorelli L., Borasio E., Finotti N., Pansarasa O., Castagna L.: In vitro antioxidant properties of amifostine (WR-2721, Ethyol). Cancer Chemother. Pharmacol., 2000; 45: 172-176
[PubMed]
[58] Matsumoto K., Krishna M.C., Mitchell J.B.: Novel pharmacokinetic measurement using electron paramagnetic resonance spectroscopy and simulation of in vivo decay of various nitroxyl spin probes in mouse blood. J. Pharmacol. Exp. Ther., 2004; 310: 1076-1083
[PubMed] [Full Text HTML] [Full Text PDF]
[59] May J.M., Mendiratta S., Hill K.E., Burk R.F.: Reduction of dehydroascorbate to ascorbate by the selenoenzyme thioredoxin reductase. J. Biol. Chem., 1997; 272: 22607-22610
[PubMed] [Full Text HTML] [Full Text PDF]
[60] McGarvey E.L., Baum L.D., Pinkerton R.C., Rogers L.M.: Psychological sequelae and alopecia among women with cancer. Cancer Pract., 2001; 9: 283-289
[PubMed]
[61] Mehlhorn R.J., Swanson C.E.: Nitroxide-stimulated H2O2 decomposition by peroxidases and pseudoperoxidases. Free Radic. Res. Commun., 1992; 17: 157-175
[PubMed]
[62] Metodiewa D., Skolimowski J., Kochman A., Koceva-Chyła A.: The paradoxical apoptotic effects of novel nitroxide antioxidants on Yoshida sarcoma cells in vivo: a commentary. Anticancer Res., 2000; 20: 2593-2599
[PubMed]
[63] Metz J.M., Smith D., Mick R., Lustig R., Mitchell J., Cherakuri M., Glatstein E., Hahn S.M.: A phase I study of topical Tempol for the prevention of alopecia induced by whole brain radiotherapy. Clin. Cancer Res., 2004; 10: 6411-6417
[PubMed] [Full Text HTML] [Full Text PDF]
[64] Mitchell J.B., DeGraff W., Kaufman D., Krishna M.C., Samuni A., Finkelstein E., Ahn M.S., Hahn S.M., Gamson J., Russo A.: Inhibition of oxygen-dependent radiation-induced damage by the nitroxide superoxide dismutase mimic, tempol. Arch. Biochem. Biophys., 1991; 289: 62-70
[PubMed]
[65] Mitchell J.B., Samuni A., Krishna M.C., DeGraff W.G., Ahn M.S., Samuni U., Russo A.: Biologically active metal-independent superoxide dismutase mimics. Biochemistry, 1990; 29: 2802-2807
[PubMed]
[66] Mitchell J.B., Xavier S., DeLuca A.M., Sowers A.L., Cook J.A., Krishna M.C., Hahn S.M., Russo A.: A low molecular weight antioxidant decreases weight and lowers tumor incidence. Free Radic. Biol. Med., 2003; 34: 93-102
[PubMed]
[67] Miura Y., Utsumi H., Hamada A.: Antioxidant activity of nitroxide radicals in lipid peroxidation of rat liver microsomes. Arch. Biochem. Biophys., 1993; 300: 148-156
[PubMed]
[68] Novak I., Harrison L.J., Kovac B., Pratt L.M.: Electronic structure of persistent radicals: nitroxides. J. Org. Chem., 2004; 69: 7628-7634
[PubMed]
[69] Rassat A.: Application of electron spin resonance to conformational analysis. Pure Appl. Chem., 1971; 25: 623-634
[70] Riley P.A.: Free radicals in biology: oxidative stress and the effects of ionizing radiation. Int. J. Radiat. Biol., 1994; 65: 27-33
[PubMed]
[71] Samuni A.M., Barenholz Y., Crommelin D.J., Zuidam N.J.: γ-irradiation damage to liposomes differing in composition and their protection by nitroxides. Free Radic. Biol. Med., 1997; 23: 972-979
[PubMed]
[72] Samuni A.M., DeGraff W., Cook J.A., Krishna M.C., Russo A., Mitchell J.B.: The effects of antioxidants on radiation-induced apoptosis pathways in TK6 cells. Free Radic. Biol. Med., 2004; 37: 1648-1655
[PubMed]
[73] Samuni A.M., DeGraff W., Krishna M.C., Mitchell J.B.: Cellular sites of H2O2-induced damage and their protection by nitroxides. Biochim. Biophys. Acta, 2001; 1525: 70-76
[PubMed]
[74] Schafer F.Q., Buettner G.R.: Redox environment of the cell as viewed through the redox state of the glutathione disulfide/glutathione couple. Free Radic. Biol. Med., 2001; 30: 1191-1212
[PubMed]
[75] Schubert R., Erker L., Barlow C., Yakushiji H., Larson D., Russo A., Mitchell J.B., Wynshaw-Boris A.: Cancer chemoprevention by the antioxidant tempol in Atm-deficient mice. Hum. Mol. Genet., 2004; 13: 1793-1802
[PubMed] [Full Text HTML] [Full Text PDF]
[76] Soule B.P., Hyodo F., Matsumoto K., Simone N.L., Cook J.A., Krishna M.C., Mitchell J.B.: The chemistry and biology of nitroxide compounds. Free Radic. Biol. Med., 2007; 42: 1632-1650
[PubMed]
[77] Swartz H.M.: Principles of the metabolism of nitroxides and their implications for spin trapping. Free Radic. Res. Commun., 1990; 9: 399-405
[PubMed]
[78] Tada M., Yokoyama H., Ito O., Ohya H., Ogata T.: Evaluation of the hepatic reduction of a nitroxide radical in rats receiving ascorbic acid, glutathione or ascorbic acid oxidase by in vivo electron spin resonance study. J. Gastroenterol. Hepatol., 2004; 19: 99-105
[PubMed]
[79] Ueda A., Nagase S., Yokoyama H., Tada M., Noda H., Ohya H., Kamada H., Hirayama A., Koyama A.: Importance of renal mitochondria in the reduction of TEMPOL, a nitroxide radical. Mol. Cell. Biochem., 2003; 244: 119-124
[PubMed]
[80] Villarini M., Moretti M., Damiani E., Greci L., Santroni A.M., Fedeli D., Falcioni G.: Detection of DNA damage in stressed trout nucleated erythrocytes using the comet assay: protection by nitroxide radicals. Free Radic. Biol. Med., 1998; 24: 1310-1315
[PubMed]
[81] Vujaskovic Z., Anscher M.S., Feng Q.F., Rabbani Z.N., Amin K., Samulski T.S., Dewhirst M.W., Haroon Z.A.: Radiation-induced hypoxia may perpetuate late normal tissue injury. Int. J. Radiat. Oncol. Biol. Phys., 2001; 50: 851-855
[PubMed]
[82] Woo R.A., Poon R.Y.: Activated oncogenes promote and cooperate with chromosomal instability for neoplastic transformation. Genes Dev., 2004; 18: 1317-1330
[PubMed] [Full Text HTML] [Full Text PDF]
[83] Xavier S., Yamada K., Samuni A.M., Samuni A., DeGraff W., Krishna M.C., Mitchell J.B.: Differential protection by nitroxides and hydroxylamines to radiation-induced and metal ion-catalyzed oxidative damage. Biochim. Biophys. Acta, 2002; 1573: 109-120
[PubMed]
[84] Zeltcer G., Berenshtein E., Kitrossky N., Chevion M., Samuni A.: Time window of nitroxide effect on myocardial ischemic-reperfusion injury potentiated by iron. Free Radic. Biol. Med. 2002; 32: 912-919
[PubMed]
[85] Zhang Q.S., Eaton L., Snyder E.R., Houghtaling S., Mitchell J.B., Finegold M., Van Waes C., Grompe M.: Tempol protects against oxidative damage and delays epithelial tumor onset in Fanconi anemia mice. Cancer Res., 2008; 68: 1601-1608
[PubMed] [Full Text HTML] [Full Text PDF]
Autorzy deklarują brak potencjalnych konfliktów interesów.
